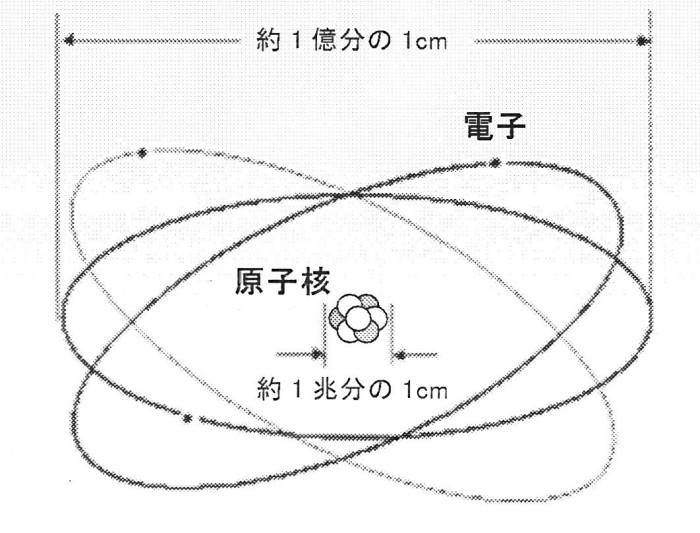
元素の基本の形
物質の最小単位を元素といいます。
中心に原子核がありまわりを電子が飛んでいます。
まず元素の基本的な図です。
まるで宇宙の太陽系と似たような形をしています。
中心の原子核が太陽で飛んでいる電子は水星、金星、地球のようなものです。
●電子殻
電子は惑星のように原子核の周りを飛んでいます。その軌道をを電子殻といいます。
惑星では軌道は1つの軌道には1つの惑星が飛んでいますが、元素の軌道は、軌道によっていくつもの電子がとびます。
電子殻(軌道)は原子核に近いほうからK・L・M・N・O・Pと名づけられてます。
K殻には電子が2個、L殻に8個、M殻に18個、N殻に32個・・・・
電子は内側の原子核に近いほうから埋まっていきます。
●電子の数と位置
軌道を飛んでいる電子の数は原子核に含まれるの陽子の数と同じです。
例えば水素は陽子が1つですからK殻に電子が1個飛び、陽子が2つのヘリウムはK殻に電子が2個飛びます。
陽子が10個のネオンはK殻に2個L殻に8個の合計10個の電子が飛ぶのです。
更に陽子が28個のニッケルはM殻までふさがって28個の電子が飛んでいます。
電子は内側の殻から埋まって、最後の外側の殻の位置によって元素の性質が決まります。
それを順番に整理したものが元素の周期表です。縦の系列が似たような性質になっています。
例えば水素、ナトリウム、カリウム、セシウムは似ていますし、マグネシウム、カルシウム、ストロンチウムも似ているのです。
●原子核
元素の中心にある原子核は陽子と中性子で出来ています。そして陽子の数が元素の名前を決めています。
1番が水素(陽子1個)、2番ヘリウム(2個)、6番炭素(6個)、8番酸素(8個)、・・・・
53番ヨウ素(53個)、55番セシウム(55個)、92番ウラン(92個)、94番プルトニウム(94個)・・・・
と言う元素の番号は原子核に含まれる陽子の数です。
●中性子
原子核を構成しているもののもう一つは中性子です。
中性子は元素の種類を決める事はありませんが元素が安定か不安定かを決めています。
不安定な放射性同位元素では放射線を出しながら陽子に変化する事もあります。
その場合陽子が1個増えます。
ヨウ素-131がベータ-線を出してキセノン-131に変化する場合がそうです。
(中性子が1個陽子になるので番号が53番から54番になるだけで総数の131は変わらない)
水素の中で一番多いH-1には中性子はありません。
●中性子の数
陽子の数が元素の種類ですが、同じ元素でもくっつく中性子の数が異なります。
例えば陽子1個の水素では中性子が0のものから6個つくものまであります。
全て水素ですが中性子が0のものは H-1
1個のものは H-2
2個のものは H-3
注:福島の事故で汚染水で除去できないトリチウムはH-3です。
6個のものは H-7 といいます
●元素の一般的な呼び方
よくストロンチウム-90、ヨウ素-131、セシウム-134、ウラン-235・・・等と言われます。
この場合後ろについている数字は陽子と中性子の合計の数です。
その合計の数字で安定した同位元素(アイソト-プ)と、不安定な放射性同位元素(ラジオアイソト-プ)に分かれるのです。
陽子の数は同じですから元素の種類は同じです。
中性子の数で安定・不安定が別れることになります。
「元素と安定」のところで一覧表がありますので参考にしてください。
1つの元素の種類で安定している物でも不安定なものでも、元素の働きとしては同じです。
ですから私たちの体は入るときには放射線を出していても安定した元素と同じように取り込んでしまいます。
安定してようがしていまいが、ヨウ素はヨウ素、セシウムはセシウムで同じで区別されません。
放射線を出すか出さないかだけなので私たちの身体は区別出来ないので困った事です。